Legemidler og biotek
Enhertu er godkjent i USA for behandling magesekkreft og i Europa for brystkreft
Den amerikanske legemiddelmyndigheten - FDA - har godkjent Daiichi Sankyo og AstraZenecas målrettede kreftlegemiddel Enhertu (trastuzumab deruxtecan) for å behandle pasienter med HER2 positiv lokalavansert eller metastatisk magesekkreft. For to dager siden fikk Enhertu også godkjenning i Europa for behandling av metastatisk HER2 positiv brystkreft.
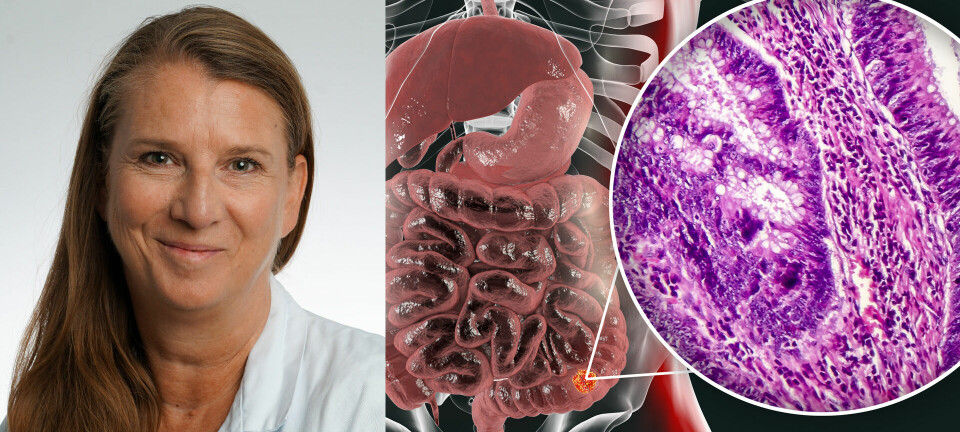
I følge Kreftregisteret fikk 392 mennesker magesekkreft i Norge i 2018. 235 menn og 157 kvinner. - De fleste pasientene med magesekkreft blir diagnostisert i den avanserte fasen og pasientene har begrensede behandlingsalternativer og har en høy dødelighet, sier overlege og leder av Norsk Gastrointestinal Cancer Gruppe (NGICG), Eva Hofsli.
Behov for ny behandling
Hun forteller at om lag en av fem pasienter med magesekkreft er HER2 positive. I dag har vi dessverre lite som vi kan tilby pasienter som ikke kan opereres og som progredierer etter førstelinjebehandling med kjemoterapi. Magesekkreft responderer på kjemoterapi men vi opplever sjeldent at behandlingen har stor effekt og effekten fortar seg temmelig raskt. Det er derfor et stort behov for nye behandlinger, sier hun.
- Studien som ligger til grunn for FDA sin godkjenning viser at Enhertu har et potensiale til å endre klinisk praksis i behandlingen av pasienter med HER2 positiv magesekkreft, sier Hofsli som særlig er imponert over overlevelsestallene. Nå ser hun frem til en europeisk godkjenning.
Det er ventet at Enhertu om ikke lenge også vil få markedsføringstillatelse for magekkreft også i Europa.
Betydelig økt overlevelse
FDAs beslutning er tatt på grunnlag av resultatene av fase II studien DESTINY-Gastric01 som ble publisert i The New England Journal of Medicine i juni i fjor.
Studien inkluderte 187 personer og viste at Enhertu ga en forbedring i objektiv responsrate (ORR) og totaloverlevelse (OS) sammenlignet med kjemoterapi for pasienter med ikke-opererbar eller metastatisk magesekkreft som hadde gjennomgått to eller flere behandlinger inkludert med Herceptin (trastuzumab) og kjemoterapi
DESTINY-Gastric01 studien viser at pasienter som ble behandlet med det målrettede kreftlegemidlet Enhertu hadde en 41% reduksjon i risiko for død sammenlignet med pasienter som fikk kjemoterapi. Gjennomsnittlig overlevelse for pasientene som fikk Enhertu som monoterapi var 12,5 måneder og 8,4 måneder i kontrollgruppen som fikk cellegift.
Over halvparten av Enhertu-pasientene var fremdeles i live etter ett år, mens færre enn 29% av pasientene som fikk cellegift var i live etter ett år. Enhertu hadde også stor effekt når det gjelder å redusere svulstene. Objektiv responsrate (ORR) var 40.5% for Enhertu som monoterapi og 11.3% for de som fikk kjemoterapi.
Enhertu ga også en progresjonsfri overlevelse (PSF) på 5.6 måneder sammenliknet med 3.5 måneder med kjemoterapi.
Antistoff-legemiddel-konjugat
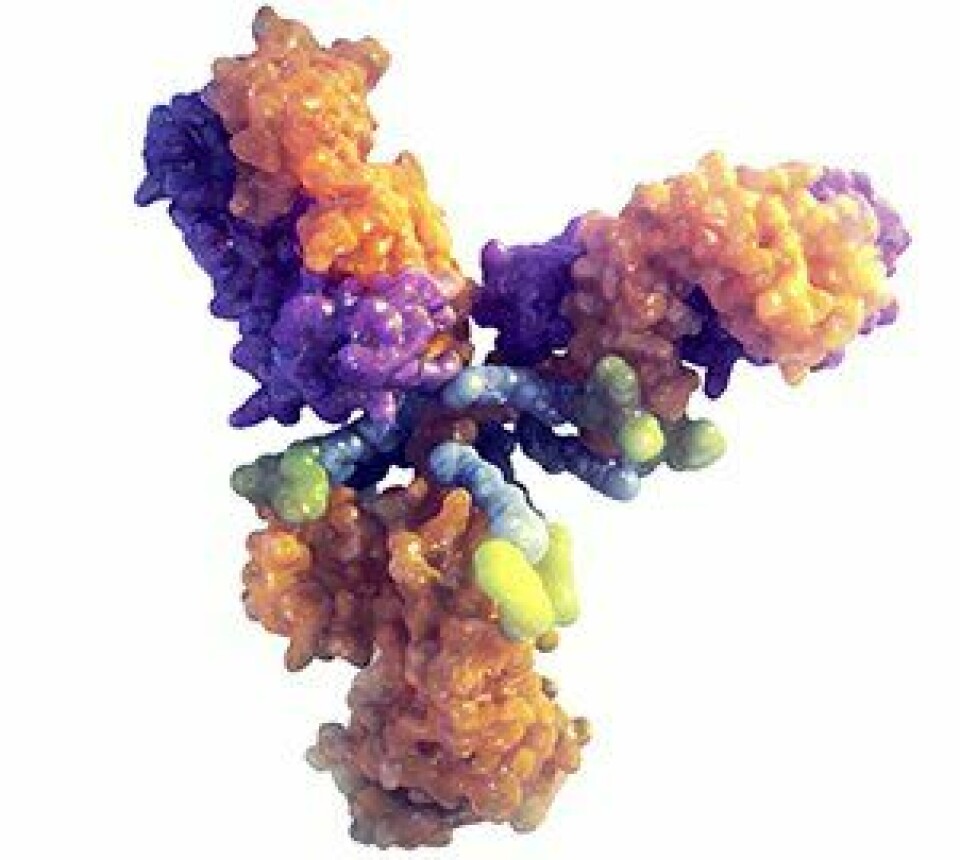
Enhertu er et antistoff-legemiddel-konjugat (ADC), en klasse kreftmedisiner som kombinerer et målrettet monoklonalt antistoff som leverer en cytotoksisk cellegift (nyttelast). Antistoffet er rettet mot og binder seg til et spesifikt antigen som bare finnes på målcellene - for Enhertu sin del er dette HER2 (Human Epidermal growth factor Receptor 2). Når Enhertu binder seg til kreftcellen, utløser den antistoffet, sammen med kjemoterapien. Dette gir medisiner med en veldig høy spesifisitet til kreftcellene, maksimerer effekten og minimerer risikoen for bivirkninger.
Trastuzumab deruxtecan er derfor et HER2-rettet antistoff-legemiddelkonjugat. På hvert antistoff (trastuzumab) finnes det i gjennomsnitt 8 cellegiftmolekyler (deruxtecan).
Trastuzumab (Herceptin) er et monoklonalt antistoff som målrettet transporterer den effektive cellegiften - deruxtekan - direkte til kreftcellenes HER2-reseptor. Ved frigjøring trenger deruxtecan gjennom cellmembranen og forårsaker DNA-skade og apoptotisk celledød (programmert celledød).
- Dette er en svært lovende og nytt behandlingsprinsipp. I dag gir vi cellegift intravenøst og det er lite - kanskje bare 1 prosent av cellegiften som faktisk tas opp i kreftcellene, sier Hofsli.
Har fått EU-godkjenning for brystkreft
Godkjenningen for behandling av magesekkreft er den andre indikasjonen som Enhertu har fått i USA. I desember i fjor fikk legemidlet FDA-godkjenning for behandlingen av HER2-positiv brystkreft.
Nå har Enhertu også fått markedsføringstillatelse i EU, og dermed også Norge for diagnosen inoperabel eller metastatisk brystkreft hos pasienter som tidligere har fått minst to andre behandlinger som er rettet mot HER2.
Grunnlaget for godkjenningen er fase 2 studien DESTINY-Breast01 som er er publisert i The New England Journal of Medicine og resultater fra fase 1 studien som ble publisert i The Lancet Oncology. DESTINY-Breast01 studien inkluderte 184 pasienter. Den viste at behandlingen med Enhertu reduserte tumoren hos 61 prosent av pasientene (ORR) i fase 2 studien og hos 50 prosent i fase 1 studien. Mest imponerende er kanskje at median progresjonsfri overlevelse (PFS) var på 16,4 måneder — som er betydelig for en pasientgruppe som allerede har blitt behandlet med HER2-legemidler minst to ganger tidligere.
På San Antonio Breast Cancer Symposium som gikk av stabelen i begynnelsen av desember, presenterte Daiichi Sankyo og AstraZeneca oppdaterte data fra denne studien. Pasientene oppnådde en responsrate (ORR) på 61,4 prosent og en median responstid (DoR) på 20,8 måneder. Median progresjonsfri overlevelse (PFS) øker til 19,4 måneder. Tall for totaloverlevelse (OS) viser at 74 prosent av pasientene - tre av fire - var i live etter 18 måneder.
En av fem brystkreftpasienter har HER2-positiv kreft. Pasienter med HER2-positive kreftceller har ofte et aggressivt kreftforløp med dårlig prognose.
Å målrette behandlingen mot HER2 har blitt en sentral strategi i bekjempelsen av brystkreft siden Herceptin (trastuzumab) ble godkjent i 1998.
I tillegg har Enhertu også en “FDA breakthrough designation” i behandlingen av pasienter med metastatisk HER2-mutert ikke småcellet lungekreft som progredierer etter behandling med kjemoterapi.
Enhertu har til og med et potensiale innen behandlingen av kreftformer som ikke er HER2-positive. I følge data som ble presentert på ESMO i september utløste Enhertu responser hos noen pasienter med HER2-lav gastrisk kreft i to kohorter i Destiny-Gastric01-studien.
Samarbeider med AstraZeneca
Det er japanske Daiichi Sankyo som har utviklet legemidlet. I mars 2019 betalte AstraZeneca 1,35 milliarder dollar til Daiichi Sankyo for å dele markedsføringsrettighetene for Enhertu utenfor Japan. AstraZenecas lisensavtale med Daiichi Sankyo kan utløse opp mot 5,6 milliarder dollar i tilleggsutbetalinger, inkludert 3,8 milliarder dollar i regulatoriske og andre milepæler og 1,75 milliarder dollar i betingede betalinger knyttet til potensielt salg.
Hans Anderssen, Redaktør i HealthTalk
Vi i HealthTalk ønsker å lage innhold som er verdifullt for deg som jobber i helsevesenet. Hvis du likte denne artikkelen, og vil at vi skal lage mer innhold som dette, kan du støtte oss ved å melde deg på vårt nyhetsbrev her.