Legemidler og biotek
Enhertu ett skritt nærmere norsk godkjenning mot brystkreft
Det europeiske legemiddelbyrået EMA anbefaler at det målrettede legemidlet Enhertu blir godkjent mot inoperabel eller metastatisk HER2-positiv brystkreft. Nå er det også presentert oppdaterte data fra DESTINY-Breast01 studien som viser at tre av fire pasienter er i live etter 18 måneder.
Brystkreft er den hyppigste formen for kreft hos kvinner. Sykdommen karakteriseres ved svært varierende forløp, fra langsomt voksende tumorer som holder seg til brystkjertelen uten å metastasere, til raskt voksende tumorer med tidlig fjernmetastasering.
En av fem brystkreftpasienter har HER2-positiv kreft. Pasienter med HER2-positive kreftceller har ofte et aggressivt kreftforløp med dårlig prognose.
HER2-rettet antistoff-legemiddelkonjugat
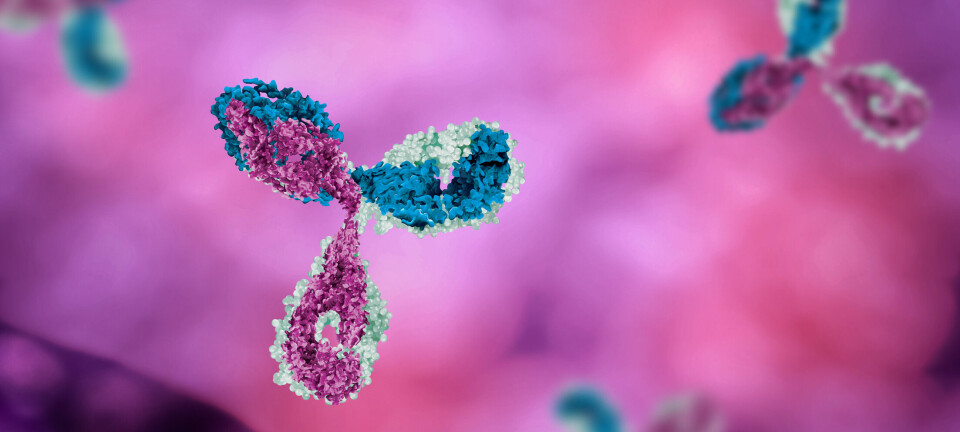
HER2 (Human Epidermal growth factor Receptor 2) er reseptorer som uttrykkes i noen kreftceller og kan brukes som mål ved målrettet behandling, og det er det Enhertu (trastuzumab deruxtecan) gjør.
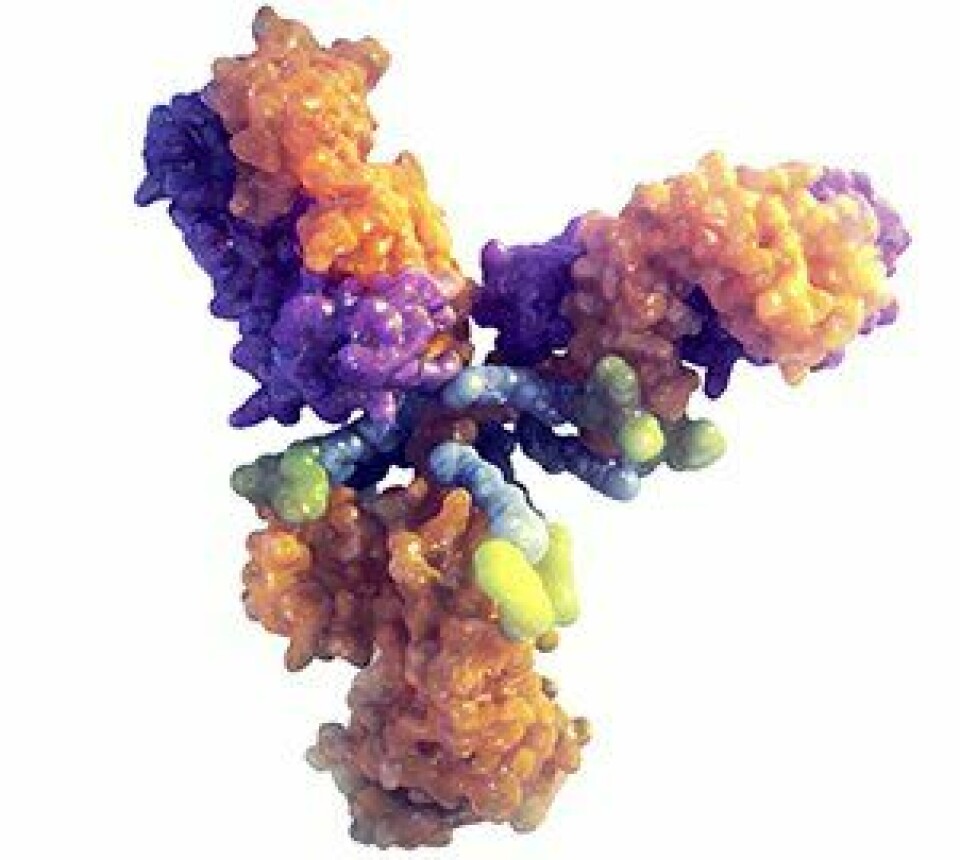
Trastuzumab deruxtecaner et HER2-rettet antistoff-legemiddelkonjugat. På hvert antistoff (trastuzumab) finnes det i gjennomsnitt 8 cellegiftmolekyler (deruxtecan).
Trastuzumab (Herceptin) er et monoklonalt antistoff som målrettet transporterer den effektive cellegiften - deruxtekan - direkte til kreftcellenes HER2-reseptor. Ved frigjøring trenger deruxtecan gjennom cellmembranen og forårsaker DNA-skade og apoptotisk celledød (programmert celledød).
Å målrette behandlingen mot HER2 har blitt en sentral strategi i bekjempelsen av brystkreft siden Herceptin (trastuzumab) ble godkjent i 1998.
Målet med behandlingen vil være å begrense sykdommen, lindre smerte og andre komplikasjoner samt forlenge livet.
Medisinsk nyvinning
Ekspertene i EMA mener at Enhertu bør godkjennes for inoperabel eller metastatisk brystkreft hos pasienter som tidligere har fått minst to andre behandlinger som er rettet mot HER2.
Det er japanske Daiichi Sankyo som har utviklet legemidlet, og de har inngått et samarbeide med Astrazeneca for å dele markedsføringsrettighetene for Enhertu utenfor Japan.
EMA mener at legemidlet er så viktig for pasientene at den har gitt søknaden akselerert prosedyre. En akselerert prosedyre gis til legemidler som anses å være en medisinsk nyvinning som fyller et udekket medisinsk behov.
- Vi er glade for at EMA har gitt en anbefaling til EU-kommisjonen om å godkjenne Enhertu siden det er et betydelige udekket medisinsk behov hos pasienter med HER2-positiv metastatisk brystkreft, sier Gilles Gallant. Han er internasjonal direktør for onkologi i Daiichi Sankyo. Trastuzumab deruxtecan er allerede tilgjengelig for pasienter med HER2-positiv metastatisk brystkreft i USA og Japan, og vi er nå et skritt nærmere å bringe denne nye medisinen til pasienter i Europa, sier han.
Øker progresjonsfri overlevelse betydelig
Søknaden om markedsføringstillatelse baserer seg på resultatene fra DESTINY-Breast01 studien som er er publisert i The New England Journal of Medicine og resultater fra fase 1 studien som ble publisert i The Lancet Oncology. DESTINY-Breast01 studien inkluderte 184 pasienter. Den viste at behandlingen med Enhertu reduserte tumoren hos 61 prosent av pasientene (ORR) i fase 2 studien og hos 50 prosent i fase 1 studien. Mest imponerende er kanskje at median progresjonsfri overlevelse (PFS) var på 16,4 måneder — som er betydelig for en pasientgruppe som allerede har blitt behandlet med HER2-legemidler minst to ganger tidligere.
Enhertu er allerede godkjent som behandling mot HER2-positiv brystkreft i USA og Japan.
Oppdaterte data på brystkreftkonferanse
På San Antonio Breast Cancer Symposium som gikk av stabelen i begynnelsen av desember, presenterte Daiichi Sankyo og AstraZeneca oppdaterte data fra fase 2 studien. De viser at pasientene oppnådde en responsrate (ORR) på 61,4 prosent og en median responstid (DoR) på 20,8 måneder. Median progresjonsfri overlevelse (PFS) øker til 19,4 måneder. Tall for totaloverlevelse (OS) viser at 74 prosent av pasientene - tre av fire - var i live etter 18 måneder.
Studien bekreftet at bivirkningsprofilen for trastuzumab deruxtecan er stabil og håndterbar.
Beslutningsforum har siste ordet
For at EMAs anbefaling skal gi en markedsføringstillatelse må EU-kommisjonen fatte et positivt vedtak. Selv om det er EU-kommisjonen som gir endelig godkjenning til nye legemidler, følger Kommisjonen som regel EMAs anbefalinger. Det vil ventelig ta et par måneder til EU-kommisjonen fatter sin beslutning. Da vil Enhertu automatisk også ha markedsføringstillatelse i Norge.
Men for at legemidlet skal bli innført i spesialisthelsetjenesten i Norge må Beslutningsforum fatte et et positivt vedtak. Det gjøres på grunnlag av en hurtig eller fullstendig metodevurdering. I tillegg kommer også vurderinger knyttet til pris etter notat fra Sykehusinnkjøp. Metodevurdering og prisnotat inngår som et grunnlag for en samlet vurdering, hvor også skjønnsmessige vurderinger skal inngå. Skjønnsmessige vurderinger er først og fremst knyttet til vurderinger av kvalitet og usikkerhet i dokumentasjonen, og til budsjettkonsekvenser.
Etter det HealthTalk kjenner til har Legemiddelverket ennå ikke startet med å utarbeide en metodevurdering. Statens legemiddelverk skal gjennomføre selve vurderingen innenfor en frist på 180 dager fra tidspunkt for mottatt dokumentasjon fra produsenten.
Samarbeider med AstraZeneca
I mars 2019 betalt AstraZeneca betalte 1,35 milliarder dollar til Daiichi Sankyo for å dele markedsføringsrettighetene for Enhertu utenfor Japan. AstraZenecas lisensavtale med Daiichi Sankyo kan utløse opp mot 5,6 milliarder dollar i tilleggsutbetalinger, inkludert 3,8 milliarder dollar i regulatoriske og andre milepæler og 1,75 milliarder dollar i betingede betalinger knyttet til potensielt salg.