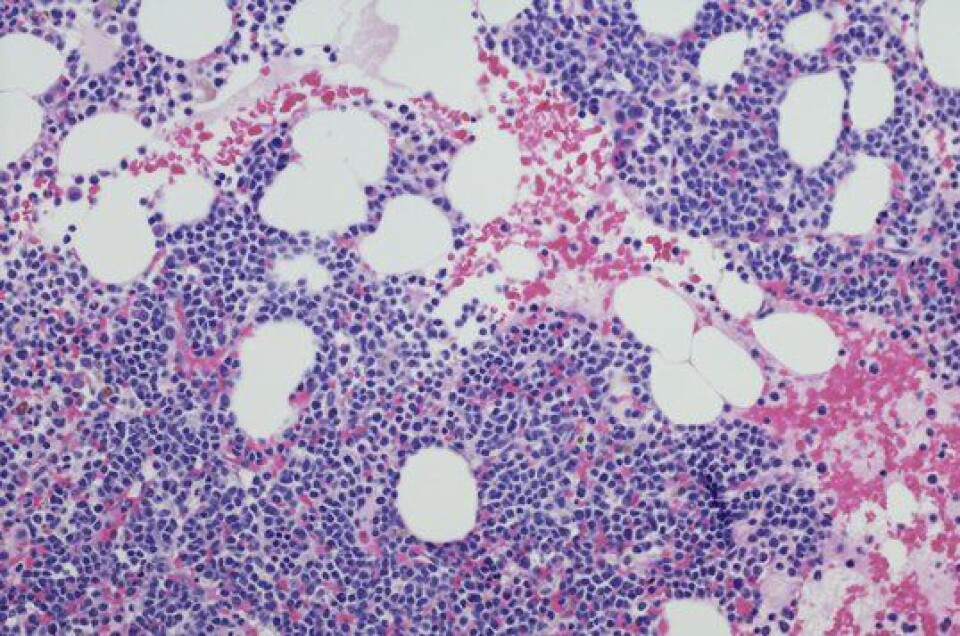
Blodkreft

Revlimid går av patent - og tas i bruk: – Flere år for sent, mener Kreftforeningen
— Årlig kan 250 pasienter ha gått glipp av denne livsforlengende behandlingen siden den kom på markedet i 2017, sier overlege Fredrik Schjesvold.
- Det er anslått at Revlimid etter stamcelletransplantasjon gir 2,3 års forlenget overlevelse i snitt per pasient. Årlig kan 250 pasienter ha gått glipp av denne livsforlengende behandlingen siden den kom på markedet i 2017, sier Fredrik Schjesvold, overlege ved Oslo universitetssykehus og leder av Oslo myelomatosesenter.
Han forteller at medikamentet er tatt i bruk i alle andre europeiske land, også land som er mye fattigere enn Norge. Medisinen kunne blitt tatt i bruk i Norge, men for fem år siden konkluderte Legemiddelverket og Beslutningsforum med at medisinen var for dyr.
- Det ble først foreslått at medikamentet skulle brukes 28 av 28 dager, men rådet fra oss var at det kun skulle brukes 21 av 28 dager, siden dette er brukt i de fleste studiene. Effekten var vel så god, det var billigere og mer tolerert blant pasientene. Uheldigvis så ble det 28 av 28 dager som ble vurdert i Legemiddelverkets metodevurdering og det gjorde hele forskjellen på å om Revlimid ble godkjent eller ikke, sier Schjesvold.
Den 17. desember 2018 konkluderte Beslutningsforum; “Lenalidomid (Revlimid) innføres ikke til vedlikeholdsbehandling av voksne pasienter med nydiagnostisert myelomatose som har gjennomgått autolog stamcelletransplantasjon.”
- Flere år for sent
Til slutt fikk Sykehusinnkjøp tilstrekkelig dokumentasjon til at de mente at Nye Metoder-systemet burde vurdere doseringen til 21 av 28. dager. Men bare tre uker senere beslutter det interregionale fagdirektørmøtet - som består av Fagdirektørene for de fire RHF-ene og som forbereder alle saker som skal opp i beslutningsforum - saken likevel ikke skulle slippe inn i Beslutningsforum. “Firmaet har gitt et pristilbud, men det er ikke grunnlag for å fremme saken for Beslutningsforum for nye metoder, står det å lese i sakspapirene. Noen begrunnelse utover dette er ikke tilgjengelig.
- I det oppdaterte prisnotat fra Sykehusinnkjøp våren 2020 sto det at Sykehusinnkjøp aksepterer at det er like god effekt av 21 av 28 dager som 28 av 28, altså samme forståelse som vi hadde. Men av en eller annen grunn ble ikke dette sendt videre til Beslutningsforum. Revlimid ville nok blitt godkjent om det hadde blitt fremlagt på nytt, men det ble det altså ikke. Våren 2020 var også lenge etter at medikamentet kunne blitt tatt i bruk, men allikevel var det to år før nå. Det er overraskende at det ikke ble gjort en ny vurdering den gangen. Nå blir Revlimid tatt i bruk, og det er jo flott, selv om det er flere år for sent, sier Schjesvold.
En tragedie
Også Kreftforeningen mener at Legemiddelverket gjorde feil da de skulle vurdere bruken av Revlimid i Norge. Siden feil dosering ble lagt til grunn, ble kostnaden for medisinen mye høyere enn den egentlig var.
- Særlig ille er dette når vi ser de feilene som er inkludert i Legemiddelverkets beregninger som ligger til grunn for avslaget. Medisinen burde vært godkjent, selv etter de ganske stramme rammene vi har her til lands. Flere fra fagmiljøene, blant andre Schjesvold, har forsøkt å påpeke dette, uten å bli lyttet til, sier generalsekretær Ingrid Stenstadvold Ross.
Kreftforeningen mener det er en tragedie at flere hundre kreftpasienter ikke har fått tilgang til en medisin som de burde ha fått, og som for mange ville hatt god effekt, og gitt dem mye ekstra tid.
- Nå oppheves patentet på dette legemidlet, slik at prisen går ned, og langt flere kommer til å få tilgang. Det er bra! Fortsatt består likevel utfordringene med at det ikke er noen reell mulighet til å klage på vurderingene fra Legemiddelverket, og at det er for lite åpenhet rundt vurderingene deres. Her mener vi at det bør gjøres grep og endringer, slik at noe lignende ikke skal skje igjen, med nye pasientgrupper.
Effekten av ulik dosering ble undersøkt
- Det er Beslutningsforum som bestemmer om legemidlet skal tas i bruk. Vår metodevurdering er en del av beslutningsgrunnlaget. Effekten av ulik dosering var undersøkt i forskjellige studier som ikke umiddelbart kunne sammenlignes. Vi gjorde derfor beregninger av ulike doseringer slik at Beslutningsforum kunne ta hensyn til dette i sin totalvurdering, sier Einar Andreassen, fungerende områdedirektør i Statens legemiddelverk.
Da Statens legemiddelverk i 2017 vurderte dette fikk de ulike tilbakemeldinger fra klinikerne om hvilken dose som ville bli brukt i praksis. I studien som lå til grunn for godkjent indikasjon og den dokumenterte effekten ble det brukt høy dosering. Det er også denne doseringen som anbefales i Helsedirektoratets retningslinjer for benmargskreft.
- Alle våre metodevurderinger er offentlige og etterprøvbare. Vi har ikke fått beskjed om at vi bør gjøre nye vurderinger basert på ny informasjon i denne saken. Vi ønsker dialog om forbedringer velkommen. Vi er derfor nå i kontakt med Kreftforeningen om denne metodevurderingen og en bedre involvering av brukere i vårt arbeid, sier Andreassen.
Forhandlingene førte ikke fram
Sykehusinnkjøp mener påstanden om 21/28-scenarioet ikke ble vurdert, ikke er riktig.
- Det er riktig at scenarioet 21/28 er beskrevet i prisnotat fra Sykehusinnkjøp våren 2020, men det er ikke korrekt at beslutningen ikke ble revurdert. Beslutningen ble tatt i interregionalt fagdirektørmøte 23. april 2020, slik det fremkommer på nyemetoder.no. Sykehusinnkjøp inviterte leverandøren til å levere inn et pristilbud på samme nivå som diskutert i forbindelse med vurderingen av 28/28-scenarioet, med en antagelse om at samme prisnivå trolig ville oppfylle prioriteringskriteriene for 21/28-scenarioet. Det var mulig i dette tilfellet fordi Statens legemiddelverk hadde vurdert begge scenarioene. Forhandlingene førte ikke fram. For Sykehusinnkjøp er det uklart hvorfor leverandøren ikke ønsket å opprettholde samme prisnivå som diskutert i 28/28-scenarioet, sier Iselin Dahlen Syversen, konstituert avdelingsleder i Nye metoder.
Fredrik Schjesvold ved Oslo universitetssykehus bekrefter at beregningene om ulike doseringer ble gjort, men siden det var 28/28 dager som ble lagt til grunn for vurderingen, så mener han det i praksis ikke hadde noen betydning.
- To klinikere, inkludert meg, anbefalte klart 21 av 28. Vi ble ikke informert om at andre klinikere hadde andre meninger, og hadde nok blitt enige om 21 av 28 dager hvis vi hadde diskutert dette oss imellom. I alle andre studier enn den omtalte, ble det brukt 21 av 28 dager. Beslutningen ble heller ikke forelagt Beslutningsforum i 2020, sier Schjesvold.
Nye metoder henviser til prisnotatet fra Sykehusinnkjøp til Fagdirektørmøtet datert 7. april 2020 der dette fremkommer:
«Sykehusinnkjøp har også bedt om innspill fra oppnevnt kliniker i LIS Spesialistgruppe onkologi. Sykehusinnkjøp har mottatt to svar. Sykehusinnkjøp HF vurderer at tilbakemeldingene bekrefter Legemiddelverkets beskrivelse i metodevurderingen (side 24); Erfaringer fra vedlikeholdsbehandling i norsk klinisk praksis antyder at doseringsregimer som avviker fra godkjent SPC kan være aktuelle. Spesielt lenalidomid administrert på dag 1-21 av hver 28-dagerssyklus (21/28-dosering) fremheves som aktuelt alternativ, og vil kunne bli benyttet i omfattende grad i norsk klinisk praksis. Dette begrunnes med at slik dosering ble benyttet i studiene GIMEMA og MYELOMA XI, og begge studiene har vist effekt mhp. tid til progresjon og/eller død; at det er billigere enn 28/28-dosering; at det kan være enklere å oppdage bivirkninger ved pause i behandlingen og at pasientene kan sette pris på en medisinfri uke. Saken ble forelagt interregionalt fagdirektørmøte som fattet beslutning 23. april 2020.»
Nei til Emplicity og Ninlaro
Etter at patentet på Revlimid (Lenalidomid) gikk ut 1. mars 2022, reduseres prisen på legemidlet med godt over 90 prosent. Dermed kan Beslutningsforum si ja til å innføre Revlimidbehandling til flere pasienter med noen typer blodkreftsykdommer. Prisreduksjonen gjorde at Beslutningsforum nylig revurderte åtte tidligere beslutninger. Emplicity (elotuzumab) og Ninlaro (iksazomib) fikk begge nei for tredje gang, mens Kyprolis (karfilzomib) i kombinasjon med lenalidomid og deksametason som andrelinjebehandling av myelomatosepasienter, fikk ja. Lenalidomid i kombinasjon med deksametason innføres også til pasienter som har fått minst én tidligere behandling.
- Kyprolis er allerede godkjent i denne behandlingslinjen, og Revlimid blir som kjent generisk fra 1. mars. Det betyr at vi ville ha brukt denne behandlingen fra det tidspunktet uavhengig av dagens godkjenning i Beslutningsforum. Vedtaket har altså ingen praktisk betydning. Dette gjelder også for innføringen av Darzalex, som er godkjent i denne linjen, og når Revlimid blir generisk vil også denne kombinasjonen tas i bruk uavhengig av et positivt vedtak i Beslutningsforum, har Schjesvold tidligere uttalt til HealthTalk.